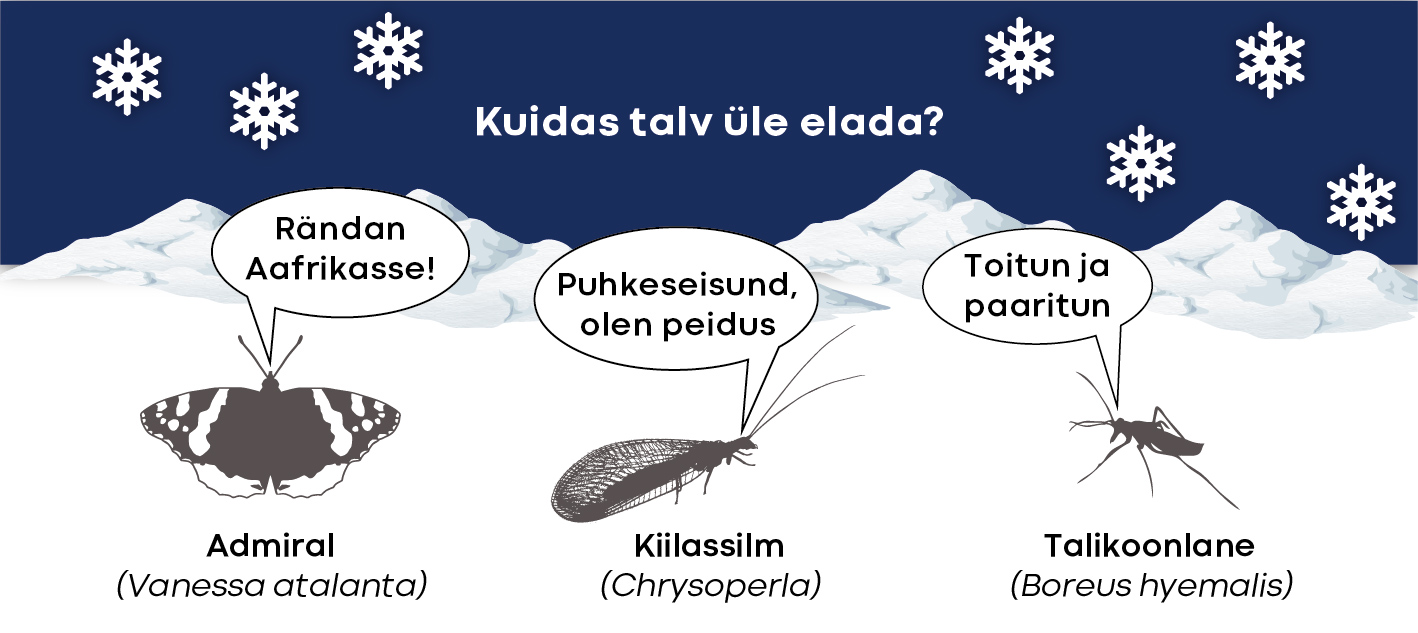
Põhjaparasvöötmes levinud asukad õitsevad, paljunevad ja kasvavad aprillist septembrini, kuid ülejäänud pool aastast on tunduvalt kasinam. Siis loomariigi isendid kas põgenevad siit, „magavad“ või katsuvad selle aja aktiivses faasis üle elada.
Tekst: TOOMAS ESPERK Fotod: URMAS TARTES
Püsisoojased loomad rakendavad kõiki kolme moodust. Näiteks rändlinnud pagevad karmide olude eest; nahkhiired, siilid, mägrad ja karud magavad talve maha, kuid enamik imetajaid ja paigalinnud tegutsevad ka talioludes.
Meie parasvöötme kõigusoojaste hulgas leidub liike, kes rändavad talve eest lõuna poole (ja kevadel jälle siia tagasi). Vast tuntuimad neist on päevaliblikad admiral ja ohakaliblikas (tema rände kohta vt [18]), kuid korrapäraselt vahetavad asukohta ka mitut liiki kiilid. Näiteks hiljuti Kabli linnujaamas tehtud sügis-tondihobu rände uuringu põhjal selgus, et ligi pooled püütud isendid olid meile jõudnud põhja poolt ja tõenäoliselt on sellele liigile omane regulaarne põhja-lõunasuunaline ränne, kuigi osaline ([16], artikli populaarteaduslik eestikeelne kokkuvõte [13]). Leidub ka talvel aktiivselt tegutsevaid kõigusoojaseid, eeskätt kalade, mõnevõrra ka selgrootute hulgas. Lumekirp, lumekärbes, lumesääsk ja talikevik on mõned näited talvel tegusate putukavalmikute kohta, aga nemadki suudavad aktiivsed olla ainult pehmemate ilmadega.
Niisiis on enamiku meie putukate taktika talv maha magada. Talveks kohale jäävad putukad on kohastunud talve siin üle elama. Selle tarbeks on neil mitmesuguseid käitumuslikke, talitluslikke ja ehituslikke kohastumusi. Diapausiga kaasnevatest kohastumustest annavad teiste hulgas põhjaliku ülevaate teadusartiklid [5] ja [20]. Väga levinud käitumuslik kohastumus on varjumine tuule ja külma eest. Talvituma minevad vastsed või nukkumisvalmis vastsed kaevuvad tihti pinnasesse, aga valmikud leiavad varjepaiga õõnsustes, koorepragudes, hiireurgudes, mahajäetud hoonetes või hooneosades.
Mõned putukad talvituvad seltsingutena; näiteks tähnik-võrkliblika isendid on sel ajal koondunud võrgendipesadesse: uuringute järgi on suuremates seltsingutes tõenäolisem talv üle elada [11]. Talitluslikult langeb putukate ainevahetustase talvel väga madalale, mis võimaldab paremini toime tulla pika toidupuuduse perioodiga [5, 6]. Vältimaks toidupuudust, koguvad ja sünteesivad putukad enne ebasoodsat aega ka varuaineid, peamiselt glükogeeni ja lipiide [5, 19].
ÜLIJAHTUMINE
Selleks et taluda madalaid temperatuure, on enamik talvituvaid parasvöötmeputukaid võimelised hoiduma külmumast isegi siis, kui temperatuur langeb alla 0 °C. See ülijahtumiseks (ingl supercooling) nimetatav seisund saavutatakse, vähendades kehas vaba vee hulka, eemaldades jää teket kiirendavaid nn jäätumistuumi (näiteks soolesisu) ja külmumispunkti alandavaid madalmolekulaarseid ühendeid (alkoholi, näiteks glütserooli) või sünteesides suhkruid, näiteks trehaloosi, või antifriisvalke [6, 21].
Ehituslikest kohastumustest on näiteks tähele pandud, et erinevalt suvel arenevast põlvkonnast ehitab kookonis nukkuvate putukate talvituv põlvkond tugevama kookoni, mis kaitseb nii veekao kui ka väljastpoolt tuleva liigse vee eest [4]. Samuti hoiab kookon talvituva putuka keha otsese kokkupuute eest jää ja lumega, mille tõttu võiks putukad läbi külmuda.
Putukad võivad talvituda kõigis arengustaadiumides. Selle kinnituseks leidub põhjaparasvöötmes putukaid, kes talvituvad munana (enamik tirtse ja ritsikaid ja mitmed liblikad, näiteks viljapuu-tupslane), vastsena (enamik kiile, siklased ja muud puidutoidulised putukad, surusääsed), nukuna (paljud liblikad, laibakärblased) või valmikuna (lapsuliblikas, koerliblikas, satelliitöölane, mitut liiki lepatriinud). Ent lisandub oluline kitsendus: talvitusstaadium on peaaegu alati liigispetsiifiline! Seega, kui üksikud erandid (näiteks orasheinasilmik suudab talvituda nii vastsena kui ka nukuna [15]) kõrvale jätta, õnnestub konkreetsel parasvöötmes elaval putukal kevadeni elada ainult siis, kui enne ebasoodsaid olusid on saavutatud kindel, just sellele liigile omane staadium. See seab putukatele kaks suurt ja huvitavat piirangut, mis peab korraga järgima. Täpsemalt, parasvöötmes suudavad pikemalt kui ühe põlvkonna vältel elada ainult sellised putukad, kelle üks arenemisjärk on kohastunud talvituma ja kes suudavad talve tulekuks saavutada arengutsüklis just selle staadiumi.
KELL TIKSUB
Talvitumise eripäradest on tingitud ka muud parasvöötme putukate eripärad teiste siin elavate loomadega võrreldes. Nii on parasvöötme putukatele äärmiselt tähtis hinnata võimalikult täpselt aastaaegade vaheldumist, kusjuures mitte ainult sügise tulles, vaid juba kevadel ja suvel. Ühelt poolt tingib seda vajadus olla talve tulles kindlas arengustaadiumis ja teisalt asjaolu, et paljude putukate elutsükkel on nii lühike, et ühe suve jooksul võib arengu teha läbi põlvkonda kaks või isegi rohkem. Olles võimeline aastaajalisust hindama, saab selline putukas varakult enne talve otsustada, kas arenguga on kiire (näiteks seetõttu, et samal aastal on võimalik läbida veel üks põlvkond) või vastupidi, tasub seda aeglustada, et talvituvast staadiumist ei saaks edasi areneda.
Parasvöötmes kajastab aastaaegade vaheldumist kõige usaldusväärsemalt päeva ja öö pikkus, valge ja pimeda aja suhe ööpäevas. Enamik parasvöötme putukaid lähtubki sellest, jälgides pimeda aja osakaalu ööpäevas [7, 17]. Arengu ajastamise seisukohalt on kevad ja sügis vastandlikud, kuid neile on iseloomulik ühesugune valge ja pimeda aja suhe. Seetõttu suudavad paljud parasvöötme putukad peale öö pikkuse eristada ka seda, kas pimeda aja osakaal väheneb või suureneb [6]. Veelgi enam, eri laiuskraadidel kannab ühesugune pimeda ja valge aja suhe eri informatsiooni selle kohta, kui kaugel talv on ja kui pikalt saab veel aktiivselt tegutseda.
Ootuspäraselt ongi tehtud kindlaks, et sama liigi eri laiuskraadidel elavad populatsioonid erinevad nn kriitilise päevapikkuse poolest: mida suurematel laiuskraadidel putukad on levinud, seda pikem on päevapikkus (tegelikult küll lühem ööpikkus), mille korral otsustatakse jääda diapausi[8, 12]. Muidugi on see üldine väide lihtsustus: kriitiline päevapikkus kujuneb paljude keskkonnategurite toimel (näiteks temperatuur ja niiskus), mida peale laiuskraadi mõjutavad muud parameetrid (merelisus, kõrgusvööndid).
Seepärast võib putukate aktiivseks elutegevuseks kohane aeg suurel määral erineda isegi sama laiuskraadi piires. Näiteks Rootsis samadel laiuskraadidel elavate orasheinasilmiku-populatsioonide kriitiline päevapikkus on erisugune ja erineb ka põlvkondade arv aastas [12]. Viimaste aastate agar uurimistöö on välja selgitanud, et kriitilist päevapikkust kujundavad nii geneetilised tegurid (eeskätt bioloogilise kellaga seotud geenid) [8] kui ka epigeneetilised, genoomivälised asjaolud [5] ja see võib väga kiiresti evolutsioneeruda [2].
SOOJENEV KLIIMA JÄTAB HÄTTA
Ülemaailmne kliimasoojenemine põhjustab ka putukatele uut laadi katsumusi. Esmapilgul peaks parasvöötme soojenemine putukatele ja teistele kõigusoojastele hästi sobima. Nii mõnigi varasem uuring (vt kokkuvõtet ja viiteid [20]) ning näiteks Eesti faunasse igal aastal lisanduvad putukaliigid kinnitavad seda arvamust. Ent uuemad uuringud on paljastanud ka ohtusid, mis soojeneva kliimaga kaasnevad (ülevaated [1, 9]). Tõusnud temperatuur, mis öö pikkuse kõrval mõjutab putukate otsust talvituda, võib meelitada putukad nn arengulõksu: anda valesignaali, mille järgi on küllalt aega, et läbida lisapõlvkond ja saavutada liigiomane talvitusstaadium, kuid tegelikult piisavat ajavaru ei ole ja lisapõlvkond hukkub [10].
Mõnevõrra üllatuslikult võib soojem talv ja sellele eelnev soe aeg, kui putukas on juba jõudnud talvitusstaadiumisse olla putukatele isegi suurem proovikivi kui külm talv. Nimelt, kõrgema temperatuuri tõttu kiireneb talvituvate putukate ainevahetus, nõnda kuluvad piiratud energiavarud jõudsamalt ning suureneb oht, et varuainetest ei pruugi kevadeni jätkuda ja putukad hukkuvad [20]. Veelgi vähem ootuspärane on asjaolu, et soojemate talvedega võib kaasneda putukate kogetavate temperatuuride langus ja suurem külmumisoht, sest isolatsioonikihina toimiv lumekiht väheneb või suisa kaob ning üha sagedamini tuleb ette külmalaineid [1, 9]. Soojad lumeta talved ja sel ajal aktiivsemaks muutuvate röövloomade tõttu (ka neil kiireneb ainevahetus ja suureneb energiavajadus) võib suureneda röövlussurve putukatele, kes talvituvad maapinnal või ülemistes pinnasekihtides [3]. Peale selle võivad putukad talvel pikemal soojaperioodil väljuda diapausist enne tegelikult sobivat aega või, vastupidi: need liigid, kes vajavad enne temperatuuri tõusu miinuskraade, võivad diapausi lõpetada liiga hilja või üldse mitte [1, 9].
Niisiis paneb elu parasvöötmes putuka proovile. Praegused suured keskkonnamuutused võimendavad raskusi veelgi, kuid nendega edukalt toime tulnud liikide ja populatsioonide isenditel on vastutasuks võimalik leida erilisi elupaiku ja rohkelt ressursse. Tõsi küll, ainult poole aasta kaupa.
1. Bale, Jeff S.; Hayward, Scott A. L. 2010. Insect overwintering in a changing climate. – Journal of Experimental Biology 213: 980–994. https://doi.org/10.1242/jeb.037911.
2. Bean, Dan W. et al. 2012. Evolution of critical day length for diapause induction enables range expansion of Diorhabda carinulata, a biological control agent against tamarisk (Tamarix spp.). – Evolutionary Applications 5: 511–523. https://doi.org/10.1111/j.1752-4571.2012.00262.x.
3. Cooper, Elizabeth J. 2014. Warmer shorter winters disrupt arctic terrestrial ecosystems. – Annual Review of Ecology, Evolution, and Systematics 45: 271–295. https://doi.org/10.1146/annurev-ecolsys-120213-091620.
4. Danks, Hugh V. 2004. The roles of insect cocoons in cold conditions. – European Journal of Entomology 101: 433–437. https://doi.org/10.14411/eje.2004.062.
5. Danks, Hugh V. 2007. The elements of seasonal adaptations in insects. – The Canadian Entomologist 139: 1–44. https://doi.org/10.4039/n06-048.
6. Denlinger, David L. 2022. Insect diapause. Cambridge University Press. https://doi.org/10.1017/9781108609364.
7. Esperk, Toomas 2021. Öö pikkus: parasvöötme putukate majakas ja oraakel. – Eesti Loodus 72 (1): 30–33.
8. Gotthard, Karl; Wheat, Christopher. 2019. Diapause: circadian clock genes are at it again. – Current Opinion in Insect Science 29: R1224–R1251. https://doi.org/10.1016/j.cub.2019.10.029.
9. Harvey, Jeffrey A. et al. 2023. Scientists’ warning on climate change and insects. – Ecological Monographs 93: e1553. https://doi.org/10.1002/ecm.1553.
10. Kerr, Natalie Z. et al. 2020. Developmental trap or demographic bonanza? Opposing consequences of earlier phenology in a changing climate for a multivoltine butterfly. – Global Change Biology 26: 2014-2027. https://doi.org/10.1111/gcb.14959.
11. Kuussaari, Mikko; Singer, Michael C. 2017. Group size, and egg and larval survival in the social butterfly Melitaea cinxia. – Annales Zoologici Fennici 54: 213–223. https://doi.org/10.5735/086.054.0119.
12. Lindestad, Olle et al. 2019. Local adaptation of photoperiodic plasticity maintains life cycle variation within latitudes in a butterfly. – Ecology 100: e02550. https://doi.org/10.1002/ecy.2550.
13. Mägi, Marko 2023. Sügis-tondihobude ränne Kabli linnujaamas. – Postimees, 12. oktoober.
14. Nielsen, Matthew E. et al. 2022. Longer and warmer prewinter periods reduce post-winter fitness in a diapausing insect. – Functional Ecology 36: 1151–1162. https://doi.org/10.1111/1365-2435.14037.
15. Nylin, Sören et al. 1989. Seasonal plasticity in growth and development of the speckled wood butterfly, Pararge aegeria (Satyrinae). – Biological Journal of the Linnean Society 38: 155–171. https://doi.org/10.1111/j.1095-8312.1989.tb01571.x.
16. Oelmann, Yvonne et al. 2023. Autumn migration of the migrant hawker (Aeshna mixta) at the Baltic coast. – Movement Ecology 11: 52. https://doi.org/10.1186/s40462-023-00415-z.
17. Saunders, David S. 2013. Insect photoperiodism: measuring the night. – Journal of Insect Physiology 59: 1–10. https://doi.org/10.1016/j.jinsphys.2012.11.003.
18. Stefanescu, Constantí et al. 2013. Multi-generational long-distance migration of insects: studying the painted lady butterfly in the Western Palaearctic. – Ecography 36: 474–486. https://doi.org/10.1111/j.1600-0587.2012.07738.x.
19. Tan, Qian Qian et al. 2017. Fatty acid synthase 2 contributes to diapause preparation in a beetle by regulating lipid accumulation and stress tolerance genes expression. – Scientific Reports 7: 40509. https://doi.org/10.1038/srep40509.
20. Tougeron, Kévin 2019. Diapause research in insects: historical review and recent work perspectives. – Entomologia Experimentalis et Applicata 167: 27–36. https://doi.org/10.1111/eea.12753.
21. Xiao, Quan-Hong et al. 2022. Physiological and biochemical differences in diapause and non-diapause pupae of Sericinus montelus (Lepidoptera: Papilionidae). – Frontiers in Physiology 13: 1031654. https://doi.org/10.3389/fphys.2022.1031654.
TOOMAS ESPERK (1977) on Tartu ülikooli entomoloogia õppetooli selgrootute zooloogia kaasprofessor.